
Hævemiddel er en samlebetegnelse for ingredienser der tilsættes bagværk med det formål at få bagværket til at vokse og blive mere luftigt. Fugt, varme eller syrlige omgivelser får hævemidlet til at producere gas (ofte kuldioxid, CO2) som bliver fanget inde i dejen som luftbobler. Når brødet eller kagen er færdigbagt har dejen "sat sig" rundt om luftboblerne, og disse udgør hulrum i bagværket, som får en tekstur der minder om en svamp.

Der findes forskellige hævemidler:
Gær
Surdej
Venskabskagen Herman
Bagepulver
Natron
Hjortetaksalt
Potaske
Piskede æggehvider
Honning-salt-hævning
(anvendes blandt andet i det nordjyske bageri Aurion,
der
arbejder efter Rudolf Steiners biodynamiske principper)
Bageferment (anvendes også af Aurion)
Se Guide til hævemidler
Gær
Gærsvampe er eukaryote mikroorganismer klassificeret i riget
Fungi med omkring 1.500 beskrevne arter. Gærsvampe tilhører ikke en enkelt
taksonomisk enhed, men er placeret i to rækker: Ascomycota og basidiomycota. De
er encellede og formerer sig oftest ved knopskydning. Gærsvampe har en
størrelsesorden på 5-10 μm og findes overalt i naturen, men specielt i
tilknytning til søde frugter, nektar m.m. Den arvelige information, der findes i
DNA hos en gærcelle, er dog 250 gange mindre end hos den humane DNA. Gær findes
i naturen, oftest steder hvor sukkerindholdet er højt. Fx på saftindholdende
frugter og på planter hvor sukkeret i plantesaften er højt (her er der tale om
udvindelse af fructose).
Gærsvampe kan normalt leve både anaerobt og aerobt. Ved
mangel på ilt kan nogle gærsvampearter producere energi ved gæring (alkoholfermentering),
hvor gærsvampene nedbryder sukker til kuldioxid, ATP (energi) og ethanol (alkohol).
Med glukose er gæringsprocessen:
C6H12O6(glukose) + 2ADP + 2Pi→
2C2H5OH + 2CO2+ 2ATP
Ved ølbrygning og vinfremstilling udnyttes ethanolen,
og ved bagning udnyttes kuldioxiden til hæving, mens alkoholen fordamper. En
gærcelle kan på en time omdanne en mængde glukose svarende til sin egen vægt.
Den ølgær, bagegær og anden kulturgær der anvendes henføres oftest til arten Saccharomyces
cerevisiae og beslægtede arter. Danskeren Emil Christian Hansen fra Carlsberg
Laboratorium udviklede i 1883 en metode til rendyrkning af gær, hvilket var et
enormt fremskridt indenfor bl.a. ølbrygning.
Den første nedskrevne beretning om brygning er 6000 år
gammel, og gær i bagning blev, så vidt vides, anvendt første gang i Ægypten for
5000 år siden. I dag anvendes gærarter der er blevet fremavlet, fx Saccharomyces
carlsbergensis fra Carlsberg bryggeri.
Når gærsvampe befinder sig i et miljø, hvor der er meget
sukker, formerer de sig hastigt ved knopskydning (anamorft). Derimod vil de i
stedet gå over til kønnet formering (teleomorft) og danne bittesmå sporer inde
i den enkelte celle, hvis der mangler sukker. Både bagegær og andre,
nærtstående slægter har denne evne til en primitiv form for kønnet formering.
Derfor samles de ofte i en særlig afdeling af gærsvampene, Hemiascomycotina.
Selv blandt de højere udviklede svampe kan man fremkalde gærfase
(gæragtig formering) i et miljø som er iltfattigt, men CO2-rigt. Meget tyder
derfor på, at gærfasen er en overlevelsesstrategi, som svampene griber til
under stress.
En anden bioteknologisk anvendelse af gærsvampe, er til
fremstilling af medicin. Novo Nordisk anvender gensplejset gær til at fremstille
hormonet insulin. Gær, især Saccharomyces cerevisiae, har i mange år været
brugt som biologisk modelorganisme for eukaryote organismer. S. cerevisiae var
den første eukaryote organisme hvis genom blev fuldstændig sekventeret.

Surdej
Surdej er en symbiotisk kultur af mælkesyrebakterier (Lactobacillus
spp.) og gærsvampe, der anvendes som hævemiddel ved brødbagning. Brød, der er
bagt med surdej, har en særlig smag, som hovedsagelig skyldes den mælkesyre,
der dannes af mælkesyrebakterierne.
Balancen mellem de aktive mikroorganismer giver forskellige
typer surdej, og det var førhen velkendt, at husmoren på nogle gårde havde
opdyrket en surdej, der var bedre end den, de fleste andre havde. Endnu i dag
findes der særligt eftertragtede surdeje, som skyldes disses omhu.
Meget af det jern, zink og magnesium, der findes i mel og
kerner er bundet af fytin og optages ikke gennem fordøjelsen. I langtidshævet
brød og i surdejsbrød aktiveres et enzym der hedder fytase, det nedbryder
fytat, således at mere jern, zink og magnesium frigives.
Surdej kan fremstilles ved at blande mel og vand.
Det skal så stå i nogle dage før det er klar til brug.
Normalt fratages der dog i stedet en klump dej ved bagning, der så bruges som
surdej ved næste bagning. Surdej er bedst inden for en uge, men kan holdes i
live ganske længe ved jævnlig tilsætning af mel og vand.
I Danmark anvendes surdej især til bagning af rugbrød.
Surdej kan også anvendes til en kage, benævnt Hermankage, hvor der er tradition
for, at surdejen deles.

Venskabskagen Herman
En kage baseret på en klat surdej har i mange år verseret
som kagernes svar på kædebreve. Man modtager klatten og rører noget i, så den
gærer til en ny stor dej; deler så videre til andre og bager det, man selv beholder,
til en kage. Hermans oprindelse skal være USA, hvor han blev udsendt fra amishfolk
som "venskabsbrød".
Hermankage er en surdejskage, som forberedes over 10 dage,
hvorefter den deles og noget af den bages, mens resten gives videre til venner.
Derfor kaldes Herman også for venskabskagen.
Anvendelse af surdej under bagning af rugbrød
I rugbrødsproduktionen er tilsætningen af syre til rugdejen
essentiel for dejens bageegenskaber. Som hovedregel skal en dej syrnes såfremt
den indeholder mere end 20% rugmel. Surdejen bidrager med konsistens, farve,
elasticitet og aroma til brødet, uden at de aktive stoffer skal skrives på
ingredienslisten.
Surdejen er en vigtig komponent i rugbrødsproduktionen.
Foruden at tilføje aroma og farve reducerer den lave pH α-amylaseaktivitet, og
muliggør herved anvendelsen af mel med lavere faldtal end ellers. Samtidig
forøges opløseligheden af pentosaner i forhold til brød uden surdej. Den
forhøjede vandbindingsevne medfører en forøget stivelsesforklistring, da
pentosanernes vandbindingsevne reduceres under bagningen. Det frigivne vand
optages herefter af stivelsen der forklistrer. Surdejen er derfor en vigtig konsistensgivende
faktor i produktionen af rugbrødsdej.
Sammensætningen og forholdet af de aromagivende stoffer i
brødet afhænger primært af surdejen, de vigtigste aromastoffer samt deres
aromaer er angivet i tabellen herunder:

Mange af disse smagsstoffer forekommer kun i meget små
koncentrationer før de giver afsmag. En god surdej indeholder mikroorganismer
der producerer overstående aromastoffer i et forhold der giver en kompleks
smag, uden stærke noter.
Syregrad og syreenheder
En surdejs ”styrke” angives i syregrad (°S) og doseres afhængigt
af opskriften i syreenheder (SE). °S defineres som antal ml 0,1M NaOH der tilsættes
10g prøve der opslæmmes i 100 mL demineraliseret vand til pH = 8,5 og anvendes
i stedet for pH, da flere af surdejens organiske syrer fungerer som buffere grundet
deres pKa. pKa for de hyppigst forekomne syrer er angivet herunder:
Mælkesyre: 3,86
Eddike: 4,75
Propionsyre: 4,88
Citronsyre: 3,13 – 4,76 – 6,39 (trivalent)
En rugdej tilsættes typisk 1.000-1.200 SE pr. kg
fuldkornsrugmel, 800 SE pr. kg halvsigtet rugmel, 400-600 SE pr. kg rugsigte og
200 SE pr. kg hvedemel. Jo lavere faldtal desto flere syreenheder tilsættes
typisk. 1g mælkesyre svarer til 111,1 SE.
Bagepulver
Bagepulver er et hævemiddel, der benyttes i bagværk.
Bagepulver består af natron (natriumhydrogenkarbonat, NaHCO3), en syre og noget
stivelse. Stivelsen kan fx være af majs eller kartofler, og er tilsat for at
holde bagepulveret tørt. Når bagepulveret kommer i forbindelse med vand
reagerer syren med natriumhydrogenkarbonat og der dannes kuldioxid (CO2), som
fanges i dejen og danner lufthuller.
Bagepulver virker hurtigere og mere effektivt end natron,
fordi det indeholder syre. Man kan se forskellen ved at tilsætte en skefuld
bagepulver og en skefuld natron til hvert sit glas vand; i samme øjeblik
pulveret tilsættes bruser vandet med bagepulver kraftigt. Dette skyldes frigivelsen
af CO2.
I vandet med natron sker denne frigivelse meget langsommere.
Når man bager med bagepulver, produceres der, i modsætning
til med natron, ikke soda.
Det engelske ord for natron er baking soda, men det
fejloversættes ofte til bagepulver (baking powder).
Natron
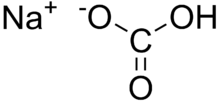
Natriumhydrogencarbonat
Natriumhydrogencarbonat eller natron, også kaldet natriumbicarbonat
eller tvekulsurt natron, er et salt af kulsyre og har formlen NaHCO3. Som tilsætningsstof
har det E-nummer E 500.
Egenskaber
Ved simpel opvarmning fraspaltes vand og kuldioxid og der
dannes soda (Na2CO3):
2 NaHCO3 →
Na2CO3 + H2O + CO2
Hvis der er syre til rådighed, dannes der ikke soda, men kun
vand og kuldioxid
H+ + NaHCO3 →
Na+ + H2O + CO2
Natron må ikke forveksles med natriumcarbonat, også kaldet
soda (Na2CO3).
Det engelske ord for natron er baking soda, men det
fejloversættes ofte til bagepulver (baking powder).
Anvendelse
Natron bruges som hævemiddel ved bagning. Under opvarmning
af natron frigives der kuldioxid (CO2) og soda (Na2CO3). Kuldioxiden får dejen
til at hæve ved at lave gasbobler i dejen.
Der frigives også CO2 ved opløsning af natron i syrer.
Dannelsen af kuldioxidgas i den sure væske giver anledning til en brusen. Dette
bruges i brusetabletter, som fx kan indeholde citronsyre og natron.
Bagepulver er en blanding af natron og en syre (H+). Ren
natron bør helst kun bruges i dej, som indeholder syre, da der ellers dannes soda,
som giver bagværket en let sæbeagtig smag. Den specielle smag udnyttes i nogle
traditionelle brød og kager, fx soda bread og brownies, der dog også tit
indeholder sure ingredienser, fx kærnemælk eller citron.
Natron kan også bruges til lettere rengøring og som lugtfjernende
middel i fx køleskabe.
Alternative ældre betydninger
Natron er et kemisk navn i brug fra gammel tid, hvor kemisk
viden var i sin barndom og terminologien mere løs. Det kan bruges om flere
stoffer.
Natron var oprindeligt den korrekte betegnelse for natriumoxid
Na2O
En vandig opløsning af natriumhydroxyd NaOH blev tidligere
kaldt natronlud, eller blot forkortet til natron. Det dannes ved at opløse natriumoxid
Na2O (natron) i vand. Dog skal nævnes at natriumhydroxyd som blev forkortet til
natron, intet har at gøre med natron som man kender det i dag. Natriumhydroxyd
betegnes i dag som kaustisk soda eller afløbsrens, som er stærkt ætsende.
Den gamle betegnelse for natriumcarbonat Na2CO3 er kulsurt
natron eller soda, hvilket i folkemunde kan forveksles med tvekulsurt natron (fork.
natron)
Hjortetakssalt
Hjortetakssalt (kan også staves hjortetaksalt) er et tilsætningsstof
til bagværk, der tilfører det sprødhed og derfor anvendes i kiks, brunkager, klejner
m.m. Dets kemiske navn er ammoniumhydrogencarbonat (NH4HCO3) og har e-nummer E-503.
Stoffet omtales også som kulsur ammoniak. Navnet hjortetakssalt
skyldes, at stoffet er et salt, der tidligere blev udvundet af hjortetakker.
Potaske
Potaske (en uren form for kaliumcarbonat) er et hvidt pulver
og salt, der kan fremstilles ved glødning af vinsten og melasse, hvortil der ledes
kuldioxid. Stoffet har den kemiske formel K2CO3 og e-nummer E-501.
Potaske har samme evne som natron og bagepulver. Under
bagningen danner de kuldioxid, en luftart, der hæver dejen og gør bagværket let
og porøst. Det er ikke varmen, men sure stoffer i dejen, der uddriver kulsyren
og får det til at hæve.
Produktet benyttes oftest som hævemiddel i dej til brunkager,
hvor det giver en speciel sprød og skør konsistens. Den bruges også som pH-regulerende
middel (neutraliserer syre) inden for bageri- og konfektureindustrien.
Kaliumcarbonat er kalium-saltet af kulsyre (carbonsyre), og
på grund af denne syres usædvanlige ioniseringsforhold har stoffet basevirkning
i vandig opløsning med fri lufttilgang, herunder i jord. Af samme grund kan
stoffet bruges som en kaliumgødning, hvor man ønsker basevirkning.
Æg
Et æg i zoologien er den eksterne entitet som indeholder
kimet til et nyt individ.
I de fleste fugle, krybdyr, insekter, bløddyr, fisk, og to
typer af pattedyr (myrepindsvin og næbdyr) er et æg (latin, ovum) en Zygote,
der følger af befrugtning af ægcellen. For at aktivere inkubation skal ægget
normalt holdes i et bestemt temperaturområde, mens det nærer og beskytter den
voksende embryo. Når fosteret er tilstrækkeligt udviklet bryder det ud af ægget.
Nogle fostre har en midlertidig ægtand til at knække, eller bryde æggeskallen
eller afdækning med.
Ovipar-dyr er dyr, der lægger æg med lidt eller ingen
udvikling af embryoet indeni moderen. Undersøgelse eller indsamling af æg, især
fugleæg, kaldes Oologi.
Fugleæg er (i modsætning til eksempelvis fiskeæg) omgivet af
en kalkskal.
Krybdyræg er om givet af en læderagtig skal.
Paddeæg er omgivet af en tyk slimklump og hænger sammen.
Fiskeæg hænger ikke sammen, men har et slimlag rundt om sig.
Retur til toppen af artiklen